
新闻资讯
免疫调节剂联合替莫唑胺治疗恶性肿瘤的研究现状
发布时间:
2020-03-12 11:08
来源:
现阶段,恶性肿瘤的治疗仍以联合治疗为主,包括不同作用机制的化学药物联合,或化学药物与手术、放疗、免疫调节剂、分子靶向药物或中医中药等的联合。免疫调节剂联合其他治疗手段已越来越普遍,因为这种联合治疗方案明显提高了恶性肿瘤的治疗效果。本文就免疫调节剂联合替莫唑胺方案治疗恶性肿瘤的研究现状作一综述。
药理学特点
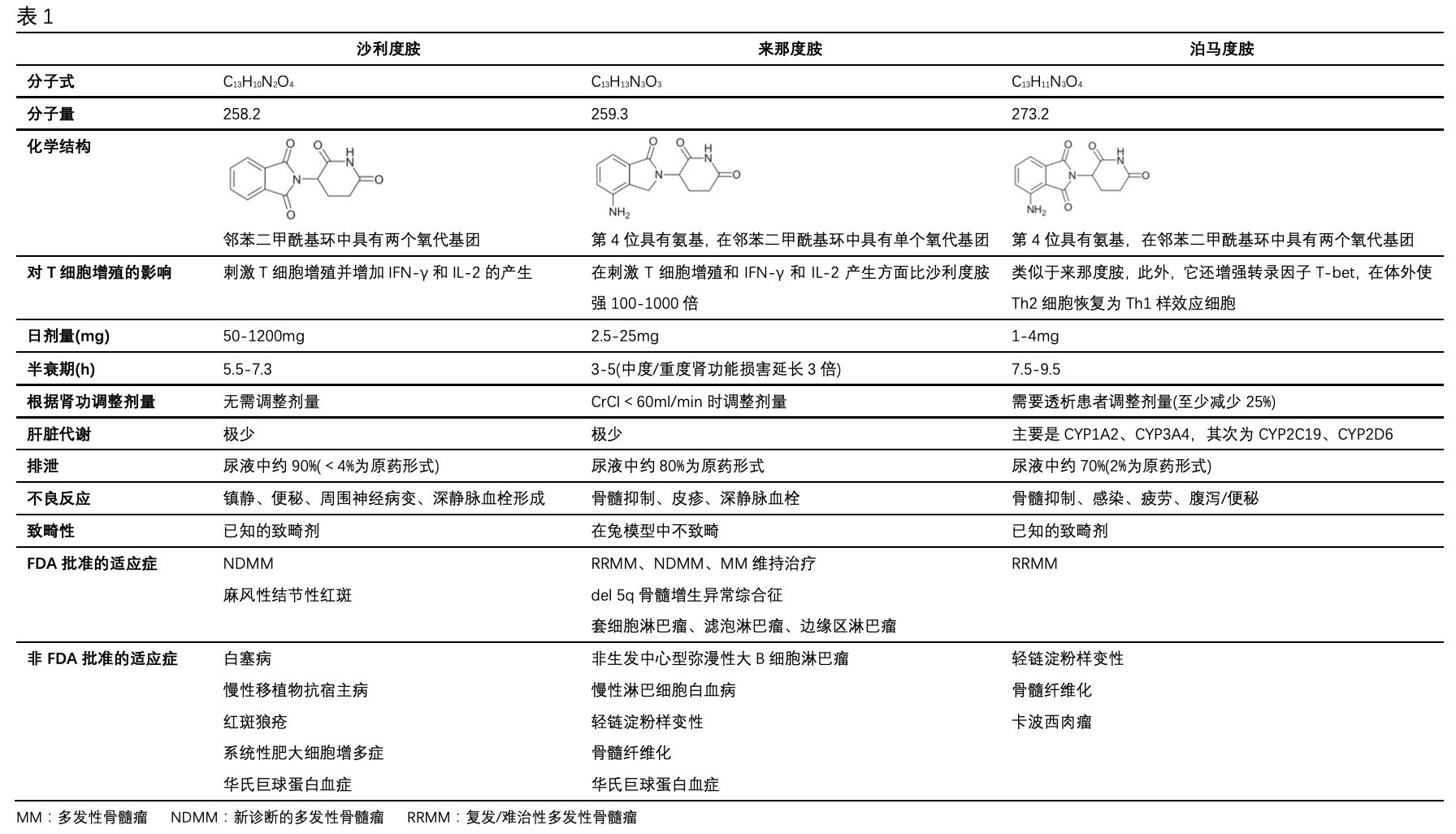
1.1 免疫调节剂
免疫调节剂(immunomodulatory drugs,IMiDs)包括沙利度胺、来那度胺、泊马度胺(详见表1)[1-3],随着IMiDs的广泛应用,肿瘤患者的预后有了很大变化。
沙利度胺是第一代免疫调节剂,是1956年最先在德国上市的一种用于治疗妊娠期恶心、呕吐的镇静剂,后因其可造成海豹肢症畸形胎儿即“反应停事件”而撤出市场[4]。1965年,以色列皮肤学家Sheskin意外地发现沙利度胺可以有效地缓解麻风性皮肤结节红斑的患者的皮肤症状[5],因而再一次激发了人们对沙利度胺的兴趣,1998年经美国食品药品监督管理局(FDA)批准,用于治疗麻风结节红斑。1999年,沙利度胺首次被证明其对传统或高剂量化疗耐药的多发性骨髓瘤有效。之后的基础与临床研究发现,沙利度胺具有抑制肿瘤血管生成、调节T淋巴细胞功能、诱导肿瘤细胞凋亡、抑制核转录因子NF-κB和调节血管内皮细胞黏附分子表达等作用机制,从而产生抗肿瘤、抗自身免疫病作用[6-9]。可与化疗联合,应用于多发性骨髓瘤、肝癌、非小细胞肺癌、神经胶质细胞瘤及恶性黑色素瘤等的辅助治疗,具有一定的疗效。目前临床研究证实沙利度胺在其他免疫系统、皮肤系统疾病中也有较好的临床疗效。但沙利度胺剂量范围在50~1200mg时都可以出现副作用,如周围神经病变、便秘、嗜睡、深静脉血栓等,很大程度上限制了其在临床中的使用。
来那度胺是沙利度胺的4-氨基-戊二酰基衍生物,是第二代的免疫调节剂,其化学性质比沙利度胺更加稳定,具有更强的血管生成抑制、肿瘤杀伤及免疫调节作用,同时可改变肿瘤微环境。因此来那度胺抗多发性骨髓瘤(Multiple myeloma,MM)活性更强,且安全性更高,适用于各阶段MM的治疗,包括移植的患者、不适合移植的患者、初治和复发的MM患者以及维持治疗[10-13],是近十余年来FDA批准的最重要的一类抗骨髓瘤药物,呈现出令人鼓舞的临床效果。国内外大量临床研究显示,来那度胺单药或与其他药物相结合可进一步增强对多种血液肿瘤和实体恶性肿瘤的临床疗效。
我公司生产的立生®️(来那度胺胶囊)是集“仿”“创”为一体的挑战专利产品,2017年11月21日获得药品生产批件及3.1类新药证书,为国内首家上市的仿制创新药。立生®️规格齐全(5mg、10mg、25mg),满足临床不同需求,实现剂量的精准调节。
泊马度胺是为第三代免疫调节剂,体外实验显示其效用是沙利度胺的100倍[14]。研究显示,泊马度胺可抑制肿瘤细胞增殖和促进其凋亡,增强T细胞和NK细胞介导的免疫,抑制单核细胞促炎性细胞因子(如TNF-α,IL-6)的生成,在小鼠肿瘤模型和体外脐带模型中显示抗血管生成作用[15]。2013年2月美国FDA批准泊马度胺用于曾接受至少两种治疗(包括来那度胺和硼替佐米)之后疾病仍然进展,以及对治疗无效且在最后一种治疗60d内发生疾病进展的MM[2,14]。
药理学特点
1.2 替莫唑胺
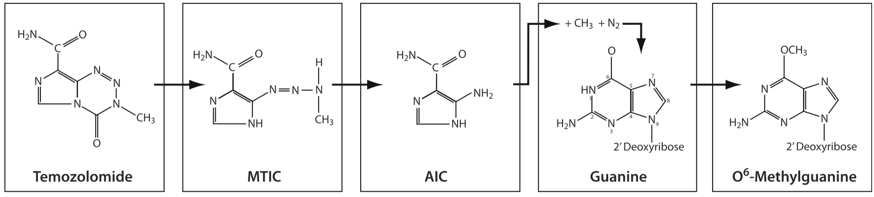
替莫唑胺(Temozomide,TMZ)是20世纪末在欧美上市的临床应用广泛的新型口服烷化剂类化疗药物,2008年在中国上市,主要用于治疗新诊断的多形性胶质母细胞瘤及常规治疗后复发或进展的多形性胶质母细胞瘤或间变性星形细胞瘤。替莫唑胺是一种含有咪唑四嗪环的烷化剂类抗肿瘤药物,在生理水平PH下经非酶途径转化为活性化合物MITC[5-(3-甲基三氮烯-1-基)咪唑-4-酰胺],后者再进一步水解成活性代谢物发挥抗肿瘤活性(图1)。替莫唑胺的主要作用机制是使肿瘤细胞的DNA出现甲基化和错配修复失败发挥细胞毒作用[16]。替莫唑胺口服吸收完全,生物利用度接近100%;最早在服药后20分钟即可达到血药峰浓度(平均时间为0.5~1.5h),体内半衰期约为1.8h;组织分布好,具有良好的血脑屏障通透性,其中枢浓度大约能到达血浆浓度的1/3~2/5;较好的安全性,无蓄积性毒性,与其他药物无叠加毒性,可单独使用或与其他抗肿瘤药物联用[17-19]。目前替莫唑胺不仅对脑胶质瘤具有较好疗效,对脑转移瘤、黑色素瘤、软组织肉瘤、原发性中枢神经系统淋巴瘤、垂体腺瘤、神经内分泌肿瘤及白血病等也有较好临床疗效。
我公司生产的交宁®️(替莫唑胺胶囊)目前一致性评价进度如下:20mg已完成现场核查,100mg正等待现场核查中。
临床应用
2.1 DLBCL中枢神经系统复发
老年弥漫性大B细胞淋巴瘤(DLBCL)患者中枢神经系统(CNS)复发迄今为止尚未有满意的临床治疗手段。这些患者通常不符合大剂量甲氨蝶呤(HD-MTX)和/或HD阿糖胞苷的条件并且预后不良,主要是因为缺乏穿过血脑屏障(BBB)且具有可控毒性的细胞毒制剂。全脑放射治疗的特点是具有显著的神经毒性,限制了其在老年患者中的使用。来那度胺通过多重作用机制发挥抗肿瘤活性,已被广泛用于DLBCL的治疗[20-23],同时亦有临床研究证实来那度胺具有良好的血脑屏障透过率,可预防CNS复发[24-26]。Emanuele Cencini等人[27]报道了一个来那度胺和替莫唑胺联合治疗老年DLBCL患者中枢神经系统复发临床案例。该例DLBCL患者为83岁女性,化疗6个月后出现中枢神经系统复发。因患者不符合放疗条件,所以进行了口服替莫唑胺250mg/d,连续5天的治疗,第1周期后无任何改善。随后采用来那度胺与替莫唑胺联合治疗,来那度胺25mg/d,d1-21,替莫唑胺250mg/d,d1-5,28天为一个周期。1个周期后患者的一般状况和认知状况迅速改善,2个周期后颅脑增强MRI显示肿瘤组织广泛减少。患者临床状态良好,治疗毒性较轻,直到第6个周期结束,脑核磁共振(MRI)检查显示病情进展,并于疾病进展的1个月后死亡。研究者根据此结果及在高龄患者方面的用药经验,认为来那度胺联合替莫唑胺可能是老年DLBCL患者中枢神经系统复发的一个可行的选择。
临床应用
2.2 转移性黑色素瘤
黑色素瘤是第三种最常见的转移到大脑的肿瘤。由于预后极差,缺乏有效的治疗,脑转移性黑色素瘤患者往往被排除在临床试验之外。凯瑟琳癌症中心从1999年便开始使用替莫唑胺联合沙利度胺治疗黑色素瘤脑转移患者,并成功治疗多例此类患者。Wen-Jen Hwu等人[28]报道了他们应用此方案的第一例患者,是一位43岁的IV期黑色素瘤脑转移的女性,替莫唑胺每天75mg/m2,持续6周,休息2周,一个疗程合计8周;沙利度胺起始剂量200mg/天,每2周以100mg的剂量递增,第一个周期内的最大剂量为400mg/天,并在治疗期间持续耐受。在接受一个周期的替莫唑胺和沙利度胺联合治疗后,患者所有部位的肿瘤都减少了50%以上。患者接受此种治疗方案的同时能正常工作,持续治疗了18个月(9个周期)。颅内病变、弥漫性视网膜病变及颅内外转移病灶均完全缓解,正电子发射计算机断层显像(PET-CT)阴性,于是停止治疗。结束治疗6个月内没有复发迹象。
随后Wen-Jen Hwu等人又开展了一项替莫唑胺联合沙利度胺治疗转移性黑色素瘤的II期临床研究[29],共纳入38例(中位年龄62岁)IV期(3例M1a, 8例M1b, 26例M1c)或IIIc期(1例)黑色素瘤患者,这些患者的中位转移灶数目为4个。患者接受替莫唑胺(75 mg/ m2/d×6周,周期间休息2周)联合沙利度胺(<70岁患者从200 mg/d开始,剂量渐增至400 mg/d;≥70岁患者从100 mg/d开始,剂量渐增至250 mg/d)治疗。治疗持续到产生不可接受的毒性或疾病进展。治疗周期中位数为2个。本研究结果表明,在晚期转移性黑色素瘤患者中,长程低剂量替莫唑胺与沙利度胺联合治疗具有显著的临床活性,6名患者(16%)有临床或外科完全缓解(CR)。通过治疗,软组织、淋巴结和肺转移瘤的消退比例超过90%,使5例PR患者借助手术转为CR成为可能。总的客观有效率为32%,包括1例持续25个月以上的CR和11例部分缓解(PR),中位生存期为9.5个月(95%置信区间,6.05~19.38个月),高于单独使用达卡巴嗪(DTIC)的经典疗效,并与DTIC联合顺铂治疗晚期类似疾病的疗效相媲美。这种持续的替莫唑胺联合沙利度胺的每日给药方案通常能被所有患者良好耐受,包括该试验中的老年患者(11名患者为>70岁)。大多数患者能够耐受计划的沙利度胺剂量提升,并且很少有患者因治疗相关毒性而停止治疗。尤其值得一提的是,仅一名患者因替莫唑胺(主要是3级淋巴细胞减少症)相关的血液学毒性而导致剂量延迟,仅两名患者因此导致停药。沙利度胺相关的神经毒性和皮疹导致几名患者停药,但严重程度为轻至中度(主要包括2级嗜睡和神经感觉功能障碍),并且在大多数患者中这些副反应均较易控制。
Wen-Jen Hwu等[30]对替莫唑胺联合沙利度胺的作用机制进行了深入研究,替莫唑胺的长程连续给药方案与传统的5天给药方案相比,该方案在4周内的药物暴露量增加了2.1倍。据推测,这一给药方案可能通过累积耗尽O6-烷基鸟嘌呤-DNA-烷基转移酶(一种参与黑色素瘤细胞对DTIC耐药的DNA修复酶)来提高抗肿瘤活性。持续给药还可通过缩短利于肿瘤生长的治疗间隔时间,从而减少发生耐药的机会。此外,长程低剂量化疗可产生抗血管生成效应,可增强其他抗血管生成药物的活性或与之协同作用,如沙利度胺。这种长程连续给药方案可能会通过减少无药间隔的时间来提高抗肿瘤活性和降低耐药性。与现有的转移性黑素瘤治疗方法相比,该方案具有许多重要优势,特别是对于老年患者。由于这两种药物都是口服药物并具有良好的耐受性,因此患者能够在家中自行进行治疗,并且只需要定期就诊进行随访。因此,该方案可以为患有晚期癌症和显著合并症的患者提供重要的生活质量益处。其次,可以推测将细胞毒性药如替莫唑胺与免疫调节和抗血管生成剂如沙利度胺等组合可以提供增强的抗肿瘤活性。第三,与DTIC和其他标准药物如顺铂相反,替莫唑胺容易穿过血脑屏障并具有降低CNS进展风险的潜力。
临床应用
2.3 脑胶质瘤
多形性胶质母细胞瘤(GBM)具有高度的血管化和过表达血管生成因子的特点,可能对抗血管生成治疗有潜在的反应。沙利度胺具有抗血管生成活性,与烷化剂替莫唑胺同时使用时,可产生增效或协同抗肿瘤作用。
高松等[31]对沙利度胺联合替莫唑胺杀伤 U251 胶质瘤细胞机制进行体外研究。实验结果显示,经体外培养的U251胶质瘤细胞予以沙利度胺联合替莫唑胺治疗后,可通过上调 MAP1LC3 表达水平而诱导肿瘤细胞发生增强的自噬性死亡;与此同时,两种药物联合应用还可通过激活肿瘤细胞 Caspase⁃3 的表达,促进细胞凋亡。通过上述两种形式促进和增强凋亡作用,沙利度胺联合替莫唑胺可使肿瘤细胞周期阻滞于G0~G1期,明显抑制肿瘤细胞的增殖。本研究初步揭示了沙利度胺联合替莫唑胺杀伤 U251 胶质瘤细胞的体外机制。
Chae-Yong Kim等[32]进行了一项关于儿童弥漫性脑桥胶质瘤放射治疗期间和之后替莫唑胺联合沙利度胺的前瞻性研究,旨在明确替莫唑胺联合沙利度胺在放疗期间和之后对新诊断的弥漫性脑桥脑胶质瘤(DPG)患儿的有效性和安全性。在2004年11月至2008年3月期间,共有17名DPG儿童患者入组,中位年龄为8岁(范围3-16岁)。同步放化疗时,替莫唑胺给药剂量为75mg/m2/d,每周7天,在放疗前1小时和在没有放疗的相似时间给予,总的使用时间不超过49天;沙利度胺每日150mg /m2/d,从放疗第一天开始给药,每隔1~2周增加一次给药剂量,耐受较好的患者可达600mg /m2/d,每日睡眠前1小时给药沙利度胺,以减少其嗜睡的副作用。休息四周后,患者接受每四周一疗程共10疗程的替莫唑胺联合沙利度胺辅助化疗,采用的是标准的五天方案,替莫唑胺的剂量在第一个周期为150 mg/m2,如果没有发生血液学毒性,第二个周期开始时增加到200 mg/m2/d。每天给予最大耐受剂量的沙利度胺,最高剂量为600 mg/m2/d。平均随访12个月(8.5-25个月)。5名患者退出研究。12名患者中有10名为PR,而1名患者表现出疾病稳定(SD),而另一名患者表现为疾病进展(PD),肿瘤控制率为92%(11/12),反应率为83%(10/12)。12名患者的中位无进展生存期(PFS)为7.2个月(95%置信区间CI,3.6-10.7个月), 6个月和12个月的PFS分别为58.3%和16.7%。总生存期(OS)为12.7个月(95%CI, 10.4-15.1个月)。1年和2年的生存率分别为58.3%和25%。主要不良反应是血液学毒性,4名患者表现出3级或4级毒性。所有患者都能很好地耐受该方案以继续辅助化疗。替莫唑胺联合沙利度胺方案良好的安全性和耐受性足以在门诊患者使用,但仍需要更大规模的研究来证明该方案的有效性。
Fabian Baumann等[33]对一组定义明确的多发性胶质母细胞瘤患者进行前瞻性研究,比较沙利度胺单药与沙利度胺联合替莫唑胺两种治疗方案的临床疗效。44名接受沙利度胺治疗至少3个月的患者(中位年龄54岁)被纳入本试验,男女比例为1.5:1,其中原发性GBM 35例(80%),复发性GBM 9例(20%)。25例患者(57%)接受沙利度胺和替莫唑胺联合治疗(TT组),19例患者(43%)仅接受沙利度胺单药治疗(T组)。T组患者每天接受200mg沙利度胺,如果耐受性良好,每两周增加100mg,直到600mg/d。TT组患者在口服沙利度胺基础上加用替莫唑胺,200mg/m2/d,1-5天,28天为一个周期,直到出现不可接受的毒性或肿瘤进展。结果显示TT组和T组中位生存时间分别为103周(95% CI, 65-141周)和63周(95% CI, 49-77周)(p<0.01)。中位肿瘤进展时间(TTP)TT组为36周(95% CI, 20-52周),T组为17周(95% CI, 13-21周)(p<0.05)。TT组14名患者(56%)和T组的6名患者(32%)在至少两次连续的神经放射学随访检查中有疾病稳定的证据。TT组疾病进展9例(36%),T组13例(68%)。TT组中有2例(8%)出现肿瘤消退反应。由此可见,沙利度胺和替莫唑胺联用安全、耐受性好,毒副反应轻微至中度。
由于泊马度胺上市时间较短,尚未见到泊马度胺联合替莫唑胺治疗肿瘤的相关报道。
结语
近些年的研究显示,免疫调节剂单药或与其他抗肿瘤药物联合在实体肿瘤中表现出较好的活性。免疫调节剂和替莫唑胺的联合应用,使更多的恶性肿瘤患者临床获益,但现有的研究样本较少,仍具有局限性,尤其是来那度胺和泊马度胺联合替莫唑胺的研究尚有待广泛开展。未来需要进行更多的研究来评估免疫调节剂联合替莫唑胺的疗效及安全性,并制定更有效的药物联合方案及最佳治疗剂量。
参考文献:

相关新闻




